This content is also available in:
English
Italiano
Português
Čeština
Română
Türkçe
Die Verarbeitung von zytologischen Präparaten umfasst die Annahme der Proben und Anforderungsformulare, Vorbereitung der Objektträger für die mikroskopische Beurteilung, Färbung, Screening und Befunderstellung. Alle diese Schritte sind einem ständigen Qualitätskontroll- und Qualitätssicherungsprozess unterworfen.
Annahme der Proben und der Anforderungsformulare
- Beschriftungen auf den Proben/Objektträgern werden mit den Angaben auf den Anforderungsformularen verglichen, um sicher zustellen dass sie übereinstimmen
- Sowohl Proben als auch Anforderungformulare müssen zumindest drei Patientinnenparameter zur Identifikation beinhalten (Vorname, Nachname, Geburtsdatum, NHS Nummer, KrankenhausIDnummer).
- Eine der Probe/dem Abstrich zugeordnete Laborreferenznummer.
- Patient ID und Probenreferenznummer müssen in ein Laborinformationsmanagementsystem eingepflegt werden (laboratory information management system – LIMS).
Präparation der Objektträger für die mikroskopische Beurteilung
- Flüssigkeitsbasierte Präparate werden nach den Angaben sowie mit produktspezifischem Zubehör des Produzenten behandelt. Die meist-verwendeten Methoden sind ThinPrep (Hologic) und SurePath, deren Manuals in den Labors aufliegen und umgesetzt warden sollten.
- Hilfreiche Links zur Ausstattung und zur Herstellung von Zellproben findet man auf der Thinprep Website: http://www.thinprep.com/hcp/ifu/
- zu BD SurePath http://www1.bd.com/anz/training/surepath
Färbung nach der Papanicolaou Methode
- Regressive Papanicoloau-Färbemethode, zur Verwendung in Färbeautomaten, wird in Tabelle 8.xx dargestellt.
- Alle Objektträger werden danach mit Eindeckmittel und Deckglas eingedeckt, und etikettiert.
- Färbecharakteristika der Kern- und Gegenfärbung sollten täglich überprüft werden
Die Papanicolaou-Färbung
Nach Jahren des Experimentierens, entwickelte Dr. Papanicolaou eine trichromatische Färbung, die bis zum heutigen Tag Anwendung findet (in leicht modifizierter Version). Die trichromatische Färbung ist eine Kombination der Kernfärbung mit Hämatoxilyn und 2 Gegenfärbungen mit OG-6 und EA-50. OG-6 färbt das Keratin während EA-50, (eine Doppelfärbung, Eosin und Azurblau) das Zytoplasma der Plattenepithelien, Nukleolen und die roten Blutkörperchen färbt.
Für ein optimales Färbeergebnis dürfen die Zellen weder vor der Fixation noch während der Verarbeitung trocknen, weil das unweigerlich zu unerwünschten Lufttrocknungsartefakten führen würde. Geringgradige Modifikationen der Färbung im Hinblick auf die erwünschte Farbabstimmung werden in den einzelnen Laboratorien oft durchgeführt: entsprechende Anpassungen ergeben sich in einer Verlängerung der Einwirkzeit von Hämatoxylin oder EA-50.
Simple Veränderungen, wie die chemische Zusammensetzung des Bläuungsmittels, die Umgebungstemperatur, der pH Wert und die Anzahl der Objektträger pro Färbevorgang können den Färbeeffekt empfindlich stören. Es ist Aufgabe des Labors, durch Qualitätskontrollmaßnahmen, eine konsistente Färbeintensität zu erhalten, dies dient im Speziellen dazu die Kerndetails klar darzustellen und die Transparenz des Zytoplasmas zu erhalten, um so die zytologische Beurteilung zu erleichtern. Eine geringe laborinterne Schwankung der Färbung ist akzeptabel.
Progressive oder regressive Färbung
Bei Verwendung der progressiven Färbemethode, wird die erwünschte Intensität der Kernfärbung während der Färbung kontrolliert und bei gewünschten Färbeergebnis abgebrochen, diese Fixierung der Farbe wird durch vollständiges Eintauchen des Abstriches in ein “Bläuungsmittel” erreicht, davor muss der Kern bis zur erforderlichen Intensität mit Hämatoxylin gefärbt werden. Das meist verwendetet Bläuungsmittel ist Scott´s tap water (pH 8.02). Bei der progressiven Färbung wird das Zytoplasma sehr schwach angefärbt.
Wird hingegen eine regressive Färbung durchgeführt, wird der Kern zuerst mit einem nicht-sauren Hämatoxylin überfärbt. Die überschüssige Farbe wird sodann in sauren Differenzierungsschritten mit wässriger Salzsäurelösung wieder entfärbt. Dieser Vorgang wird durch fließendes Leitungswasser gestoppt. Bei der regressiven Färbung ist das richtige Timing sehr wichtig, ein zu lange andauernder Entfärbevorgang bewirkt, dass hyperchromatischer Kerne hypochromatisch werden.
Weitere Variablen für die Beeinflußung der Papanicolaou-Färbung sind neben der gewählten Färbemethode auch die Herkunft der Farbchargen mit ihren zahlreichen Farbstoffkomponenten (je nach Hersteller) und der pH-Wert des Zellabstrichs. Die Papanicolaou-Färbung ist eine qualitative Färbung und darf nicht als eine exakt stöichiometrische (quantitative) Färbung betrachtet werden.
Beide Pap-Färbemethoden funktionieren, eine dieser beiden Methoden sollte angewendet werden. Die Färbeergebnisse und diagnostischen Möglichkeiten sind vergleichbar.
Charakteristika der Papanicolaou-FärbungKerne
|
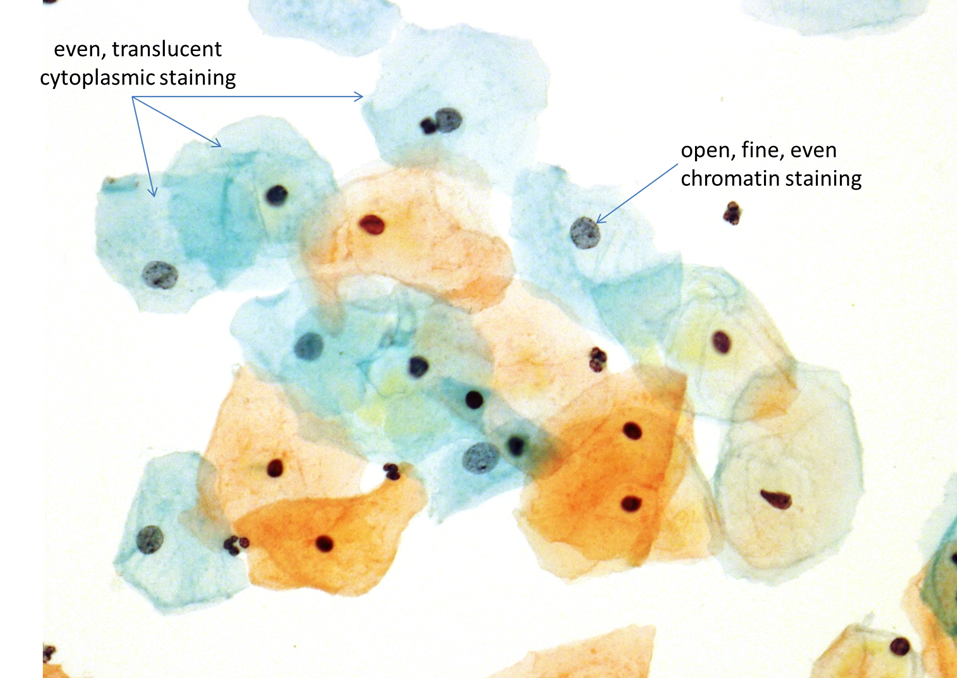
Table 8.1. Regressive Papanicolaou-Färbemethode (Färbeautomat)
|
Station |
Lösung |
Zeit (Minuten) |
|
1 |
95% Alkohol |
1:30 |
|
2 |
70% Alkohol |
1:30 |
|
3 |
Hämatoxylin |
4:00 |
|
4 |
Wässrige HCl |
0:05 |
|
Wash 1 |
Wasser |
waschen |
|
Wash 2 |
Wasser |
waschen |
|
Wash 3 |
Wasser |
waschen |
|
Wash 4 |
Wasser |
waschen |
|
5 |
70% Alkohol |
2:00 |
|
6 |
95% Alkohol |
1:00 |
|
7 |
OG6 |
2:00 |
|
8 |
95% Alkohol |
0:10 |
|
9 |
95% Alkohol |
0:10 |
|
10 |
EA50 |
6:00 |
|
11 |
95% Alkohol |
0:15 |
|
12 |
95% Alkohol |
0:15 |
|
13 |
Absoluter Alkohol |
1:00 |
|
14 |
Absoluter Alkohol |
1:00 |
|
15 |
Absoluter Alkohol |
1:00 |
|
16 |
Xylol |
3:00 |
|
17 |
Xylol |
2:00 |
|
Exit |
Xylol |
1:00 |
Screening und Befunderstellung in der Zytologie
- Ein Zytotechniker/Eine Zytotechnikerin oder ein Zytoscreener/eine Zytoscreenerin mustert die Abstriche vor (Screening).
- Je nach den landesüblichen, gesetzlichen Vorgaben, müssen alle als negativ oder inadäquat (nicht repräsentativ) vorbefundeten Abstriche in einem schnellen Review und alle als abnorm eingestuften Abstriche vollständig von einem erfahrenen Zytotechniker/einer erfahrenen Zytotechnikerin nochmals begutachtet werden.
- Negative und inadäquate Ergebnisse dürfen unter entsprechenden landesspezifischen Vorgaben selbstverantwortlich endbefundet werden.
- Sämtliche abnormen zytologischen Abstriche warden, abhängig von den gesetzlichen Regelungen zur Endbefundung, entweder an einen Pathologen/eine Pathologin, einen erfahrenen Zytotechniker/eine erfahrene Zytotechnikerin bzw. Biomed. Analytiker/Biomed. Analytikerin zur Endbefundung übergeben.
- Der endgültige Befund wird unterzeichnet, gespeichert und entweder über den Postweg oder elektronisch an den Einsender/die Einsenderin übermittelt.
- Die Endbefunde beinhalten eine Empfehlung für das Patientinnenmanagement, wie z.B. kolposkopische Untersuchung oder bei inadäquaten, nicht repräsentativen Abstrichen eine Abstrichwiederholung.
- HPV-Test wird bei Bedarf zur Triage von ASC-US/LSIL durchgeführt oder als Test of Cure (ToC) nach Konisation.
- Die Patientin wird über das Testergebnis informiert.
- Der Einsender/Die Einsenderin (Kliniker/Klinikerin oder das Krankenhaus) hat dafür Sorge zu tragen, dass bei abnormen Befunden eine adäquate Behandlung der Patientin erfolgt, außer es gibt andere schriftliche Übereinkünfte in Bezug auf eine Zuweisung zur Kolposkopie oder Einforderung einer Abstrichwiederholung.
- Ein Erinnerungssystem zur Kolposkopie-Terminvereinbarung und Abstrichwiederholung sollte vorhanden sein.
Diese Arbeitsvorgänge können zwischen den einzelnen Labors und Ländern variieren, sie sollten aber den europäischen Leitlinien für Qualitätssicherung im Zervixkarzinomscreening folgen (Wiener et al.)
Protokolle für das Screening konventioneller und flüssigkeitsbasierter Zytologie
Screening- und Befundprotokolle mit integrierten Qualitätskontrollmessungen sollten vom Labormanager/von der Labormanagerin in Zusammenarbeit mit der Institutsleitung implementiert werden.
Um sein Fachwissen ständig weiter zu entwickeln, sollten ZytotechnikerInnen ein großes Ausmaß an zytologischen Abstrichen sehen. Für Labors gilt ein Mindestmaß von 15000 Zervixabstrichen/Jahr und von jedem Screener/jeder Screenerin sollten 50 (konventionelle) oder 80 (LBC) Abstriche pro Tag mit regelmäßigen Pausen bearbeitet warden können. Dem Screener/Der Screenerin sollte ein eigener Arbeitsplatz mit einem binokularen Mikroskop zur Verfügung stehen und ein Mindestausmaß von 3000 zytologischen Präparaten pro Jahr sollte gewährleistet sein.
Das Screening der vorbereiteten Abstriche auf abnorme Zellen erfolgt mit 10-fach Objektiv und 10-fach Okular, dieses Objektiv wird für das Screening des gesamten Abstrichs verwendet. Der Screener/Die Screenerin sollte Blickfeld um Blickfeld erfassen, bis der gesamte Abstrich durchgemustert ist. Es ist üblich an einem Ende des Objektträgers zu beginnen und sich Schritt für Schritt, mäanderförmig weiterzuarbeiten, bis das gesamte Areal vollständig mikroskopiert wurde.

Innerhalb eines Abstrichs werden ca. 250-300 Blickfelder beim Screening erfasst (unter Verwendung eines 10-fach Objektivs). Die mittlere Zeit für diesen Vorgang wird für die konventionelle Zytologie mit ca. 6-10 Minuten angegeben (Schwankungsbereich 5-20 Minuten).
Die Aufgabe des Screeners/der Screenerin ist das Markieren verdächtiger Zellen im Zervixabstrich. Zur Markierung bzw. Bepunktung sollte das 4-fach Objektiv verwendet werden. Die Anleitung zum Markieren eines Abstrichs sollte durch das Labor erfolgen. Gewöhnlich werden bunte Filzstifte (Marker) für LBC verwendet und weisse Tinte für das Markieren konventioneller Abstriche. Zur Beurteilung verdächtiger Zellen sollte ein 20-fach oder 40-fach Objektiv verwendet werden.
Vor dem Screening eines Abstrichs sollte sich der Zytologe/die Zytologin vergewissern, dass das Anforderungsformular vorhanden ist und diese Angaben als auch die Screeninghistorie (im EDV-System) berücksichtigen.
Anleitung für das Screening eines ThinPrep Abstrichs
- Ein Umstieg von konventioneller Zytologie auf flüßigkeitsbasierte Zytologie (LBC) muss unter der Voraussetzung geschehen, dass der Zytologe/die Zytologin eine entsprechende Schulung erhält.
- ThinPrep verwendet, im Unterschied zum ethanolbasierten Fixanz in der konventionellen Zytologie, ein Fixanz auf Methanolbasis. Kernedetails sind in ThinPrep Abstrichen sehr gut erhalten, aber die Kernmembran stellt sich deutlicher dar, was eine Abgrenzung zur unreifen Metaplasie und HSIL erschweren kann.
- Das Screening von ThinPrep Abstrichen kann entweder in Längsrichtung oder Querrichtung erfolgen, je nach Präferenz des Zytologen/der Zytologin.
- Es existieren keine speziellen Leitlinien für das Rapid-Rescreening oder Pre-View.
Anleitung für das Screening eines SurePath Abstrichs
- Ein Umstieg von konventioneller Zytologie auf flüßigkeitsbasierte Zytologie (LBC) muss unter der Voraussetzung geschehen, dass der Zytologe/die Zytologin eine entsprechende Schulung erhält.
- Das Fixanz, das bei SurePath zum Einsatz kommt ist auf Ethanolbasis und vergleichbar mit dem Fixanz das für konventionelle Zytologie verwendet wird.
- Obwohl das Areal eines SurePath-Präparats kleiner ist als das Areal eines ThinPreps, sollte die Zeit des Screenings nicht kürzer ausfallen: SurePath Präparate sind keine Monolayer-Präparate (bestehen aus mehreren Zelllagen), deshalb ist es wichtig dreidimensionale Zellgruppen immer bei starker Vergrößerung gezielt zu fokussieren (drehen der Mikrometerschraube).
- AnwenderInnen von SurePath empfehlen ein Rapidscreening (schnelles Screening) des gesamten Areals, gefolgt von einem langsamen Screening mit besonderer Rüchsichtnahme auf dreidimensionale Gruppen. (persönliche Auskunft: N. Dudding)
- Es existieren keine speziellen Leitlinien für das Rapid-Rescreening oder Pre-Screening.
Training für flüssigkeitsbasierte Zytologie (LBC)
|

