This content is also available in:
English
Italiano
Deutsch
O processamento de amostras de citologia envolve a recepção de amostras, do formulário de solicitação, a preparação de lâminas, a coloração, a análise microscópica para a triagem e descrição dos resultados. Todos esses processos estão sujeitos a controles de qualidade e exigem medidas de garantia da qualidade
Recepção de amostras e formulário de solicitação
- Detalhes sobre a amostra e formulário são verificados para garantir que eles correspondam entre si.
- Amostras e formulário devem ter pelo menos três identificadores das pacientes (nome, sobrenome, data de nascimento, número do cadastro no sistema de saúde nacional, o telefone do hospital ou local de origem).
- Número de referência do laboratório designado.
- Paciente ID e número de referência da amostra que entrou no sistema de gerenciamento de informações de laboratório.
Preparação das lâminas para exame microscópico
- As lâminas de base líquida são preparadas utilizando o equipamento e instruções dos fabricantes. Os métodos mais utilizados são ThinPrep ( Hologic ) e SurePath , cujos manuais deverão estar disponíveis e serem seguidos no laboratório.
- Links para todos os equipamentos ThinPrep e métodos para a coleta de amostras estão indicadas no site principal: http://www.thinprep.com/hcp/ifu/
- Links para BD SurePath: http://www1.bd.com/anz/training/surepath
Coloração pelo método de Papanicolaou
- Método regressivo Papanicolaou, mostrado na Tabela 8.xx, é utilizado em máquinas automáticas de coloração
- Todas as lâminas são rotuladas e montadas com lamínulas.
- O controle das características de coloração de núcleos e citoplasmas é feito diariamente.
O método de coloração de Papanicolaou
Depois de anos de experimentação, Dr Papanicolaou desenvolveu uma técnica tricromática de coloração que é utilizada até os dias de hoje, (embora ligeiramente modificada). Esta técnica é uma combinação de um corante básico com afinidade nuclear: hematoxilina e dois corantes citoplasmáticos, OG-6 e EA-50. OG-6 cora a queratina, enquanto EA-50, (corante duplo, eosina e verde luz) cora com tonalidades diferentes o citoplasma das células epiteliais escamosas, os nucléolos e as hemácias. Para obter uma coloração ideal, não deixar que, antes ou durante o processamento, as células sejam expostas ao ar, pois o dessecamento vai produzir artefatos indesejados. Cada laboratório pode produzir modificações na técnica buscando um equilíbrio de matizes de cores, de acordo com sua preferência. Os ajustes podem ser feitos através da alteração da duração do tempo de exposição das lâminas na hematoxilina e no EA-50.
Simples variações, como a composição química da água da torneira, a temperatura ambiente, pH da amostra e número de lâminas coradas por lote, podem afetar o equilíbrio entre as diferentes matizes de cores. Os laboratórios devem, através de verificações de controle de qualidade, manter uma intensidade de coloração constante para facilitar os diagnósticos citológicos consistentes.
A variabilidade inter-laboratorial dos diferentes matizes de cores é aceitável, desde que o detalhe nuclear esteja claramente definido e a transparência do citoplasma mantida.
Coloração progressiva ou regressiva
Ao utilizar o método progressivo, a intensidade da coloração nuclear é controlada pela imersão da lâmina em um agente de “azulamento” após o núcleo ter sido corado com a intensidade necessária pela hematoxilina. O agente azulador mais comumente utilizada é a água da torneira de Scott (pH 8,02).
A coloração progressiva cora muito levemente o citoplasma.
Quando se utiliza o método de coloração regressiva, o núcleo é deliberadamente super corado com hematoxilina não acidificada. O excesso de corante é removido com uma solução de ácido clorídrico diluído (água ácida). O processo de descoloração é então interrompido por imersão da lâmina em água corrente. O controle do tempo é crucial no método regressivo, pois a descoloração excessiva pode transformar um núcleo hipercromático em hipocrômico.
Uma última consideração a respeito da coloração de Papanicolaou, é que os resultados não dependem apenas do método utilizado, mas também das características comerciais dos corantes e do pH da amostragem celular. Portanto, a coloração de Papanicolaou não pode ser considerada como exata e perfeita.
Ambos os métodos funcionam bem e, independente da escolha de um dos métodos pelo laboratório, os resultados de coloração e a capacidade de diagnóstico são comparáveis.
Características da coloração de Papanicolaou
|
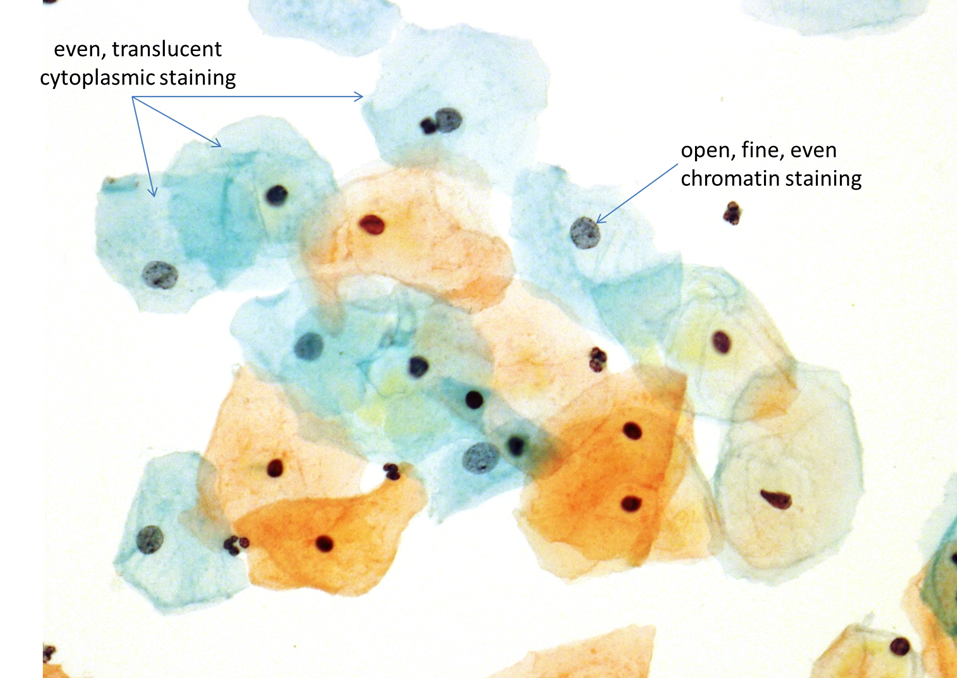
Tabela 8.1. Método regressivo da coloração de Papanicolaou (Coradora automática)
|
Cuba/Berço |
Solução |
Tempo (minutes) |
|
1 |
Álcool 95% |
1:30 |
|
2 |
Álcool 70% |
1:30 |
|
3 |
Hematoxilina |
4:00 |
|
4 |
Água ácida |
0:05 |
|
Banho 1 |
Água |
Lavar |
|
Banho 2 |
Água |
Lavar |
|
Banho 3 |
Água |
Lavar |
|
Banho 4 |
Água |
Lavar |
|
5 |
Álcool 70% |
2:00 |
|
6 |
Álcool 95% |
1:00 |
|
7 |
OG6 |
2:00 |
|
8 |
Álcool 95% |
0:10 |
|
9 |
Álcool 95% |
0:10 |
|
10 |
EA50 |
6:00 |
|
11 |
Álcool 95% |
0:15 |
|
12 |
Álcool 95% |
0:15 |
|
13 |
Álcool Absoluto |
1:00 |
|
14 |
Álcool Absoluto |
1:00 |
|
15 |
Álcool Absoluto |
1:00 |
|
16 |
Xileno |
3:00 |
|
17 |
Xileno |
2:00 |
|
Final |
Xileno |
1:00 |
Escrutínio (screening) e emissão de relatório citopatológico
- O escrutínio das lâminas é realizado pelo citotecnologista/ citotécnico.
- De acordo os protocolos locais, todas as lâminas avaliadas com o resultado negativo ou inadequado são rapidamente revistas e, qualquer caso com achado anormal é encaminhado ao citotecnologista sênior para reavaliação.
- Os resultados tidos como negativos e inadequados são assinados e liberados de acordo com os protocolos locais.
- Todas as lâminas de citologia com achados anormais são encaminhadas para um patologista/citopatologista, um citotécnico sênior ou um biomédico especialista, dependendo dos protocolos locais para a emissão de um relatório final.
- Um relatório final é assinado, registrado, enviado eletronicamente ou por correio, para o responsável pela coleta.
- Os relatórios finais incluem uma recomendação de conduta, tais como encaminhamento para exame colposcópico ou a repetição da coleta, se a amostra é inadequada.
- O teste de HPV é indicado para triagem em casos de ASC-US / Baixo grau ou para controle de cura após o tratamento da NIC.
- A paciente é informada sobre o resultado.
- O médico ou a clínica que coletou a amostra é responsável por garantir que sejam tomadas medidas adequadas em caso de resultado anormal, a menos que outros protocolos escritos estejam em vigor, que permitam o encaminhamento para colposcopia e solicitação de repetição de exames.
- Um aviso que demonstre os casos que necessitam de encaminhamento para colposcopia e os casos em que a coleta deve ser repetida deve estar disponível no local.
Estes procedimentos podem variar entre laboratórios, regiões e países, mas devem seguir as orientações européias para a garantia de qualidade no rastreio do câncer do colo do útero (Wiener et al.)
Protocolos de rastreamento citologia convencional e em meio líquido
O gerente do laboratório, em colaboração com os patologistas / citopatologistas, são os responsáveis pela definição de protocolos de escrutínio e de emissão de relatórios com resultados, e por implantar as medidas de controle de qualidade.
O citotecnologista/ citotécnico deve examinar uma grande variedade de casos, para desenvolver competências. Os laboratórios devem processar pelo menos 15.000 amostras cervicais por ano. Espera – se que cada escrutinador examine 50 (convencional) ou 80 (citologia em base líquida) esfregaços por dia com descanso em intervalos regulares.
Cada profissional escrutinador deve ter sua própria estação de trabalho e um microscópio binocular, e devem alcançar o mínimo de 3.000 casos examinados por ano.
A objetiva e a ocular de 10x são utilizadas para o rastreio de células anormais na lâmina. O profissional deve examinar a lâmina, progredindo campo a campo, até que toda a área sob a lamínula seja inspecionada. É comum iniciar a análise num dos cantos da lâmina e terminar no outro.

Estima-se que um profissional escrutinador examine cerca de 250-300 campos de visão durante o processo de rastreio de uma única lâmina (usando uma objetiva 10X ). O tempo médio necessário para concluir esse processo para a citologia convencional é de 6-10 minutos (intervalo de 5 a 20 minutos) .
O dever do profissional escrutinador é marcar células alteradas detectadas no esfregaço cervical. Para fazer a marcação usa- se a objetiva de 4X. O protocolo de cores a serem usadas para marcação deve ser decidido pelo laboratório. As canetas coloridas de tinta permanente e ponta de feltro são normalmente utilizadas na triagem da citologia em base líquida. Um pontilhando de tinta branca é usado em um esfregaço convencional. Deve – se utilizar objetiva de 20X ou 40X ao inspecionar áreas ou células de interesse.
O formulário de solicitação com a história do rastreio citológico do colo das amostras, deve ser lido pelo citologista antes de examinar cada um dos esfregaços.
Protocolos para o escrutínio de uma lâmina pelo método ThinPre
- Deve- se disponibilizar treinamento para os citotécnicos e citopatologistas, acostumados a examinar esfregaços convencionais, adaptarem – se a analise de uma lâmina de citologia em base líquida, em qualquer tecnologia usada.
- ThinPrep utiliza um fixador à base de metanol , que difere do fixador para o esfregaço convencional, à base de etanol . O detalhe nuclear é bem preservado em lâminas ThinPrep, mas a membrana nuclear é mais destacada , o que pode afetar a diferenciação entre metaplasia escamosa imatura e HSIL .
- O escrutínio das lâminas ThinPrep pode ser feito de um lado para outro ou de cima para baixo, como preferir o citotécnico e/ou citopatologista.
- Não estão disponíveis orientações específicas para revisão rápida ou análise prévia.
Protocolos para o escrutínio de uma lâmina pelo método SurePath
- Deve-se disponibilizar treinamento para os citotécnicos e citopatologistas, acostumados a examinar esfregaços convencionais, adaptarem – se a analise de uma lâmina de citologia em base líquida, em qualquer tecnologia usada.
- O fixador utilizado em SurePath é à base de etanol, semelhante ao utilizado no citologia convencional .
- Embora a área de células para o escrutínio de uma preparação SurePath seja menor do que a de uma preparação ThinPrep , o tempo necessário para escrutinar a lâmina não deve ser mais curto: as preparações SurePath não são em monocamadas, portanto é necessário utilizar os recursos focais do microscópio para examinar em diferentes planos os grupos celulares tridimensionais.
- Examinadores usuários de SurePath recomendam uma visão rápida de toda a lâmina e em seguida, a observação cuidadosa de todos os grupos celulares tridimensionais. (comunicação pessoal N. Dudding)
Não estão disponíveis orientações específicas para revisão rápida ou análise prévia.
Treinamento para a citologia em meio líquido
|

