This content is also available in:
English
Português
Deutsch
Linee guida per la raccolta del campione
Le linee guida per la raccolta dei campioni sono disponibili sia per la citologia tradizionale che per quella su base liquida ed entrambe hanno la stessa efficacia finchè si seguono le linee guida (NHSCSP 2006); Arbyn et al. 2007).
Condizioni cliniche richieste per la raccolta del campione
I campioni cervicali andrebbero raccolti a metà del ciclo: i campioni mestruali potrebbero essere oscurati dal sangue e dalla cellule endometriali sfaldatesi alcuni giorni prima o dopo la mestruazione e portare ad una errata interpretazione delle alterazioni cellulari.
L’informazione accurata sull’età e data di nascita della paziente, la data dell’ultima mestruazione, i sintomi, se presenti, e l’anamnesi dei precedenti screening dovrebbero essere forniti sulla richiesta e potrebbero essere rilevanti nell’interpretazione delle eventuali alterazioni citologiche o per una corretta indicazione del follow up. Per esempio, la presenza in un campione di cellule endometriali è rilevante solo per le donne sopra i 40 anni.
|
Procedura per la raccolta del campione
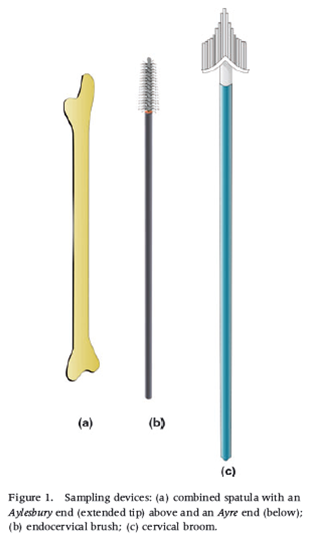
Quando il clinico o l’infermiera raccoglie un campione per la citologia convenzionale, usa una spatola lunga o uno degli estremi della spatola Ayre in base all’età e alla parità della paziente, con o senza lo spazzolino. Uno spazzolino particolare è usato per la citologia su strato liquido (Figura 8.1).
Strumenti per la raccolta dei campioni cervicali
- Spatola di Aylesbury (versione modificata della spatola di Ayre) per il campionamento della cervice e della zona di trasformazione.
- Spazzolino endocervicale per il campionamento dell’endocervice.
- Spazzolino cervicale per la citologia su strato liquido.
Una volta che gli strumenti son pronti, il clinico o l’infermiera può preparare il paziente per la procedura.
- Lo speculum viene inserito nella vagina: la cervice deve essere chiaramente visualizzata usando direttamente una sorgente luminosa e l’ostio cervicale ben identificato.
- Lo strumento per il campionamento deve essere scelto accuratamente in base alla forma e alla dimensione della cervice e alla posizione della giunzione squamocolonnare.
- Il tappo mucoso viene gentilmente rimosso in modo che la spatola/spazzolino sia in diretto contatto con la superficie epiteliale, altrimenti non potrebbero venir raccolte abbastanza cellule e il campione viene oscurato dal muco e dalle cellule infiammatorie.
- La spatola di Aylesbury o la porzione superiore della spatola di Ayre è indicata per il campionamento della cervice di una donna giovane o nullipara. (Figura 8.3).
- L’estremo arrotondato è indicato per una donna paripara. Con la spatola, potrebbe servire anche uno spazzolino per la cervice di una donna in post-menopausa dove la giunzione squamocolonnare giace all’interno del canale cervicale (Figura 8.4 a e b).
- Lo strumento “a scopino” (broom) dovrebbe essere rotato di 3600 cinque volte per raccogliere le cellule dalla zona di trasformazione, giunzione squamocollonare e canale endocervicale. Lo spazzolino può essere usato sia per lo striscio convezionale (Figura 8.4) che per quello su strato liquido (Figura 8.4.c e 8.6).
- Il materiale sulla spatola o sullo spazzolino deve essere trasferito immediatamente su un vetrino per la citologia convenzionale o nel liquido per la citologia su base liquida, entrambi precedentemente etichettati con il nome e la data di nascita della paziente.
- La spatola e lo spazzolino andrebbero strisciati sullo stesso vetrino il più velocemente possibile prima che le cellule del primo campione si asciughino all’aria. (Figura 8.4 d.)
- Per la citologia convenzionale, il vetrino deve essere fissato immediatamente con un fissativo appropriato (alcol 95%) e trasportato insieme agli altri campioni al laboratorio di citologia in un contenitore con la richiesta corrispondente per essere processato (Figura 8.5).
- I campioni per la citologia su base liquida dovrebbero essere processati strettamente in accordo con le istruzioni del fabbricante. Dopo il campionamento, se si usa il medoto Surepath, la punta dello strumento deve essere spezzata all’interno del contenitore fornito e portata al laboratorio per la processazione. Invece, se si usa il metodo Thinprep, è ancora più importante che la punta dello strumento non sia inclusa nel contenitore. (Figura 8.6).
|
La spatola, lo spazzolino o lo “scopino” dovrebbero essere rotati di 3600 più di una volta in modo da assicurare un campionamento adeguato della zona di trasformazione. Se non si seguono queste indicazioni, c’è il rischio che le cellule anormali presenti sulla cervice non siano raccolte e, di conseguenza, non siano presenti nel vetrino |
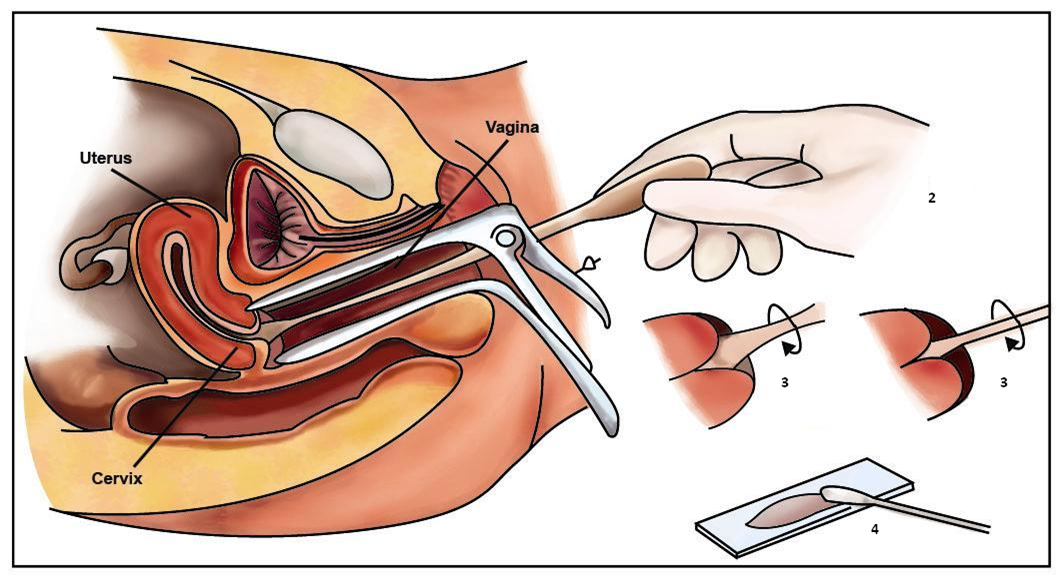
Figura 8.4. Spatola o spazzolino per raccogliere e preparare il campione per lo striscio tradizionale (Figure 2, 4 e 5 da Arbyn et al. 2007)?
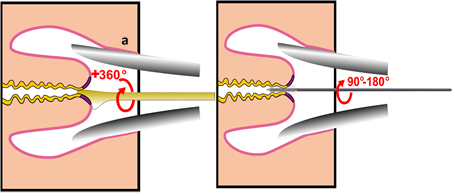
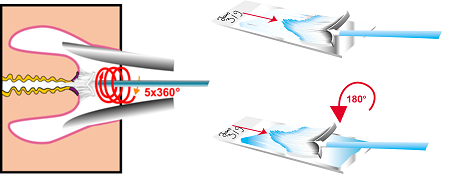
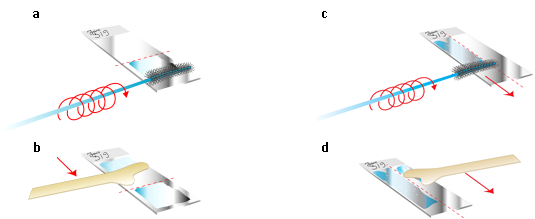

Figura 8.6. Sciacquare lo spazzolino in un fissativo commerciale usando le istruzioni del produttore per il Thin prep


Fissazione degli strisci convenzionali
Una adeguata fissazione è una fase importante nella preparazione di uno striscio. Assicura che le cellule siano ben colorate e disposte in modo chiaro per l’esame microscopico e preservate per una revisione sia immediata che futura.
La fissazione viene ottenuta da una saturazione completa o immersione del vetrino in uno dei tanti fissativi a base di alcol elencati di seguito per 15-20 minuti, dopo di che il vetrino può essere rimosso dal fissativo e trasportato al laboratorio per la colorazione. Si può utilizzare anche uno spray fissativo (Figura 8.5).
Lo spray fissativo consiste di una base alcolica e carbowax (polietilene) che forma un sottile strato protettivo di cera sul vetrino. Il carbowax va rimosso tramite l’immersione in alcol prima della colorazione.
Fissativi raccomandati per la citologia convenzionale:
95% etanolo (per una eccellente fissazione)
80% isopropanolo
95% alcol denaturato (90 parti 95% etanolo, cinque parti di metanolo assoluto e cinque parti isopropanolo assoluto)
Alcol per reagenti (metanolo assoluto, 80% isopropanolo, 90% acetone)
La fissazione deve avvenire immediatamente. Lo stricio non si deve asciugare prima della fissazione.
Un fissativo soddisfacente per la citologia deve soddisfare diversi criteri:
- Dovrebbe penetrare nelle cellule rapidamente così che la morfologia venga mantenuta
- La contrazione delle cellule deve essere minima e uniforme così che non si verifichino distorsioni morfologiche.
- Dovrebbe permettere la permeabilità delle colorazioni attaverso la membrana cellulare in modo adeguato rispetto al metodo di colorazione usato.
- Dovrebbe facilitare l’aderenza delle cellule al vetro del vetrino.
- Dovrebbe essere battericida, non tossico e permanente.
I vantaggi della citologia su strato liquido (LBC)
|
Accuratezza della LBC rispetto alla citilogia tradizionale
I primi studi suggerivano che la citologia su base liquida avesse una sensibilità maggiore rispetto a quella tradizionale nella diagnosi di LSIL o di lesioni più gravi, anche se i risultati variavano tra i diversi centri (Lee et al. 1997).
Una decade più tardi, una metanalisi mostrava che non c’era evidenza di una sensibilità e specificità maggiori ma che vi era una notevole eterogeneità tra gli studi (Arbyn et al. 2008). L’istituto nazionale per l’eccellenza clinica ha raccomandato di utilizzare la citologia su base liquida per lo screening cervicale nazionale basandosi su una valutazione di tecnologia sanitaria (Health Technology Assessment, Karnon et al. 2004).
|
L’istituto nazionale per l’eccellenza clinica (NICE) ha concluso che la LBC era “altrettanto sensibile se non migliore rispetto alla citologia convenzionale“ (2003) e aveva, inoltre, anche altri vantaggi elencati di seguito. |
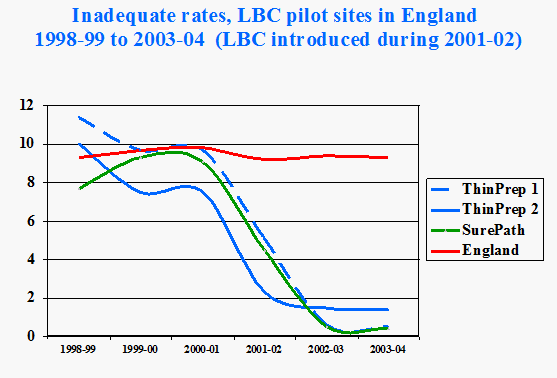
Il motivo principale dell’introduzione in Inghilterra della LBC fu la riduzione consistente dei test inadeguati da circa il 10% a meno del 2% (Figura 8.5), che non si era vista in nessuno studio nel mondo (Davey et al. 2006).
La LBC elimina virtualmente i campioni oscurati da essudato, sangue o con artefatti da asciugamento all’aria (Siebers et al. 2012) che prima venivano inseriti nella categoria “soddisfacenti ma limitati da”. I criteri per stabilire l’adeguatezza di un campione saranni trattati altrove.